2023年5月1日,72886必赢欢迎光临黄卫华教授团队和法国巴黎高等师范学院Christian Amatore教授合作,在国际知名期刊《PNAS》上发表题为“Nanoelectrochemistry reveals how soluble Aβ42oligomers alter vesicular storage and release of glutamate”的研究成果。
该成果利用团队前期发展的谷氨酸纳米电化学传感器(Angew. Chem. Int. Ed., 2021, 60, 15803-15808),定量监测了可溶性Aβ42寡聚体对神经元囊泡内谷氨酸储存和释放的影响过程,进一步结合分子生物学表征及动物模型验证,初步揭示了阿尔茨海默病(Alzheimer’s disease, AD)不同阶段Aβ42寡聚体导致细胞胞吐紊乱机制。
论文第一作者是72886必赢欢迎光临博士后杨小柯,通讯作者是黄卫华教授和Christian Amatore教授。该研究得到了国家自然科学基金、中国博士后科学基金以及中法“纳米生物催化电化学国际研究项目(IRP NanoBioCatEchem)”的资助。

AD是一种中枢神经系统退行性疾病,研究表明其发生发展与致病性淀粉样蛋白-β(Aβ)在大脑中积累以及突触功能障碍和神经元大量死亡密切相关。大量证据表明无论是在AD动物模型还是患者中Aβ都造成了兴奋性突触的损伤,并且可明显观察到谷氨酸稳态受损。在中枢神经系统中,谷氨酸(Glutamate, Glu)是一种主要的兴奋性神经递质,其在囊泡内含量、胞吐释放量以及相应的释放比例对于突触可塑性以及学习、记忆机制的形成至关重要,但在单细胞及单囊泡水平,Aβ42寡聚体影响谷氨酸含量及其胞吐的过程与机制尚不明确。
为了回答上述问题,作者首先采用Aβ42寡聚体孵育原代海马神经元,构建了AD不同时期对应的细胞模型;并采用谷氨酸纳米线传感器,定量监测了AD细胞模型不同时期囊泡谷氨酸含量及其胞吐释放量的变化;进一步结合细胞和分子生物学方法以及动物模型验证,作者发现:1)在AD早期,Aβ42寡聚体通过上调I型囊泡谷氨酸转运蛋白(VGLUT1)的表达,促进囊泡对谷氨酸的装载,进而增加囊泡谷氨酸含量及其释放量,引起神经元兴奋性损伤;2)随着疾病进程,Aβ42寡聚体通过上调自发释放相关蛋白Vti1a的表达,提高神经元囊泡谷氨酸自发释放频率,伴随着VGLUT1蛋白表达的下调,最终导致AD晚期囊泡内谷氨酸含量及其释放量显著降低,神经元功能丧失(图1)。这些结果为深入理解AD的发生、发展机制以及探索AD预防及治疗方案提供了重要参考。然而,本工作还有不足之处:在研究对象上,本文的电化学检测集中在培养的神经元,这不足以模拟神经系统内分子和细胞类型相互作用的复杂性,未来应在脑片乃至活体水平实时探测谷氨酸动态变化过程;在机制探究方面,Aβ42寡聚体通过何种方式和途径介导VGLUT1蛋白以及Vti1a蛋白的表达尚不明确,还有待深入研究。
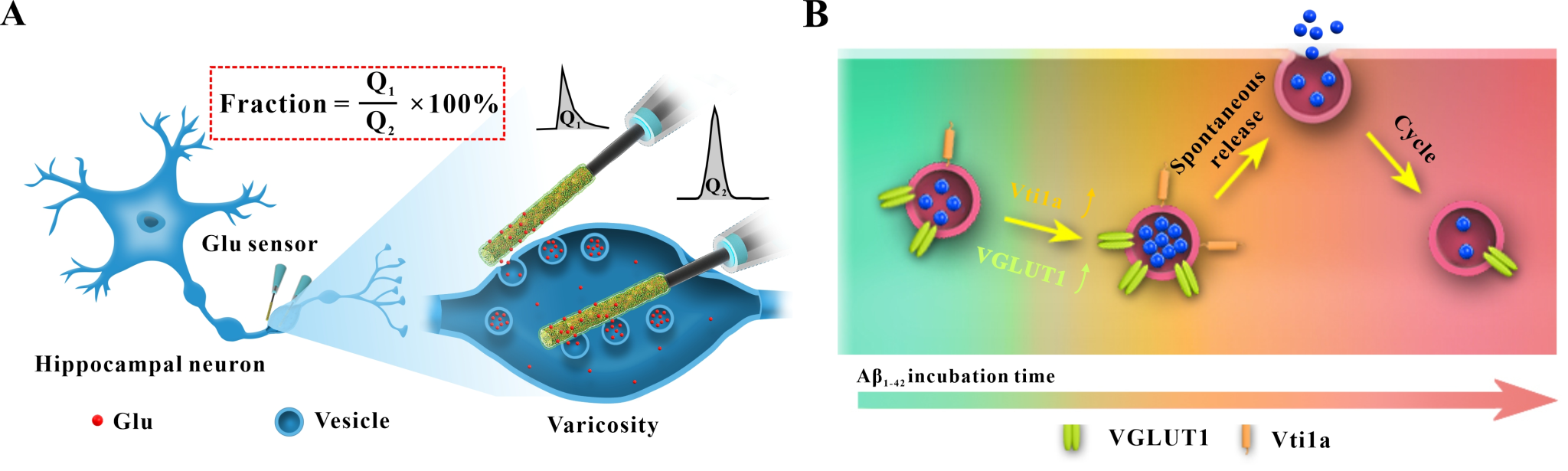
图1.(A)神经元曲张体囊泡谷氨酸含量及其释放量检测示意图;(B)AD不同阶段Aβ42寡聚体影响细胞胞吐紊乱机制。
原文链接:https://www.pnas.org/doi/10.1073/pnas.2219994120